Extinction de la chaux
La chaux vive peut être "éteinte" c'est-à-dire hydratée si l'on désire en faire d'autres utilisations.
Il y a trois manières de l'éteindre :
-On plonge les cailloux dans des fosses d'eau.
Cette hydratation provoque la désintégration des pierres ainsi qu'un fort dégagement de chaleur (600°C). L'eau bout au contact des pierres et peut causer des projections.
La chaux se dépose alors au fond, on obtient ainsi une pâte. Elle peut être mélangée à du sable pour obtenir du mortier, on peut aussi obtenir un badigeon de chaux en ajoutant de l'eau.
-La chaux peut être éteinte à l'étouffée : on la mélange à du sable, la chaux va absorber l'eau du sable pour s'hydrater, mais la réaction est plus lente. On obtient ainsi un mortier prêt à l'emploi.
-Aujourd'hui la chaux est aussi éteinte par projection d'eau, pas plus qu'il ne faut pour son hydratation, ainsi, on obtient de la chaux en poudre.
Dans le cas de chaux hydraulique (connue à partir du XIXème siècle - voir ci-après ce qu'est la chaux hydraulique), il faut veiller de ne pas mettre plus d'eau que nécessaire, afin qu'elle ne durcisse pas. En cas de chaux aérienne (calcaire pur) la quantité d'eau n'est pas limitée.
La chaux est appelée chaux éteinte, car elle ne réagit plus vivement à l'eau. De manière scientifique elle est appelée l'hydroxyde de calcium (Ca(OH)2).
La réaction chimique est la suivante :
CaO + H2O => Ca(OH)2
Celle-ci est utilisée pour faire le mortier, des enduits, mais aussi le chaulage...
Cette chaux devait être conservée à l'abri de l'humidité et de l'air.
On distingue alors deux types de chaux éteintes :
La chaux aérienne, connue depuis l'antiquité est obtenue avec un calcaire pur, elle a la particularité de durcir à l'air, d'où son nom.
Sa prise s'effectue par carbonatation, c'est-à-dire en absorbant du dioxyde de carbone présent dans l'air.
Ca(OH)2 + CO2 => CaCO3 + H2O.
Le CaCO3 ainsi créé est du carbonate de calcium, autrement dit, du calcaire. D'où la chaux est qualifié de matériau naturel.
La réaction se produit en plus ou moins de temps, en fonction de l'humidité, qui est tout de même nécessaire, en fait l'eau s'allie avec le CO2 pour former de l'acide carbonique (H2CO3), la chaux fixe ensuite le dioxyde de carbone de cet acide pour se transformer en calcaire. C'est pour cela que la présence d'eau est indispensable, même si c'est la présence de l'air qui le fait durcir (ainsi on a trouvé de la chaux non durcie à l'intérieur des épais murs médiévaux). L'eau libérée lors de la réaction reforme de l'acide carbonique qui va être fixé par la chaux, etc....
Ca(OH)2 + CO2 + H2O => Ca(OH)2 + H2CO3 => CaCO3 + 2 H2O
La chaux hydraulique, découverte au XIXème siècle, est obtenue avec un calcaire contenant un certain pourcentage d'argile, elle est appelée ainsi, car elle durcit, en quelques heures, en présence d'eau.
A la cuisson, la silice (SiO2) et l'alumine contenues dans l'argile vont se combiner à la chaux pour former des silicates de calcium et des alumines de calcium.
Lors de l'extinction de la chaux et surtout lors de la prise du mortier ces molécules vont donner des hydrates. Contrairement à la chaux hydraulique, la chaux doit être éteinte avec la quantité juste d'eau, pas plus, sous peine de durcir. La prise hydraulique est due à ces silicates, toutefois la chaux hydraulique conserve une part de chaux aérienne. La prise aérienne d'une chaux hydraulique avoisine les 30 %. La chaux et les hydrates vont se carbonater au contact de l'air humide, ce qui est la partie aérienne de la prise, ce qui va redonner le calcaire et la silice originelles.
Si le rapport d'argile est encore plus élevé et la température encore plus haute (1400°C), cela donne du ciment. La grande différence est que la silice contenue dans l'argile est alors vitrifiée lors de la cuisson. En mortier, il ne reconstitue pas du calcaire d'origine, mais un autre matériau, c'est pour cela qu'il est dit non-naturel, contrairement à la chaux.
La chaux vive peut être "éteinte" c'est-à-dire hydratée si l'on désire en faire d'autres utilisations.
Il y a trois manières de l'éteindre :
-On plonge les cailloux dans des fosses d'eau.
Cette hydratation provoque la désintégration des pierres ainsi qu'un fort dégagement de chaleur (600°C). L'eau bout au contact des pierres et peut causer des projections.
La chaux se dépose alors au fond, on obtient ainsi une pâte. Elle peut être mélangée à du sable pour obtenir du mortier, on peut aussi obtenir un badigeon de chaux en ajoutant de l'eau.
-La chaux peut être éteinte à l'étouffée : on la mélange à du sable, la chaux va absorber l'eau du sable pour s'hydrater, mais la réaction est plus lente. On obtient ainsi un mortier prêt à l'emploi.
-Aujourd'hui la chaux est aussi éteinte par projection d'eau, pas plus qu'il ne faut pour son hydratation, ainsi, on obtient de la chaux en poudre.
Dans le cas de chaux hydraulique (connue à partir du XIXème siècle - voir ci-après ce qu'est la chaux hydraulique), il faut veiller de ne pas mettre plus d'eau que nécessaire, afin qu'elle ne durcisse pas. En cas de chaux aérienne (calcaire pur) la quantité d'eau n'est pas limitée.
La chaux est appelée chaux éteinte, car elle ne réagit plus vivement à l'eau. De manière scientifique elle est appelée l'hydroxyde de calcium (Ca(OH)2).
La réaction chimique est la suivante :
CaO + H2O => Ca(OH)2
Celle-ci est utilisée pour faire le mortier, des enduits, mais aussi le chaulage...
Cette chaux devait être conservée à l'abri de l'humidité et de l'air.
On distingue alors deux types de chaux éteintes :
La chaux aérienne, connue depuis l'antiquité est obtenue avec un calcaire pur, elle a la particularité de durcir à l'air, d'où son nom.
Sa prise s'effectue par carbonatation, c'est-à-dire en absorbant du dioxyde de carbone présent dans l'air.
Ca(OH)2 + CO2 => CaCO3 + H2O.
Le CaCO3 ainsi créé est du carbonate de calcium, autrement dit, du calcaire. D'où la chaux est qualifié de matériau naturel.
La réaction se produit en plus ou moins de temps, en fonction de l'humidité, qui est tout de même nécessaire, en fait l'eau s'allie avec le CO2 pour former de l'acide carbonique (H2CO3), la chaux fixe ensuite le dioxyde de carbone de cet acide pour se transformer en calcaire. C'est pour cela que la présence d'eau est indispensable, même si c'est la présence de l'air qui le fait durcir (ainsi on a trouvé de la chaux non durcie à l'intérieur des épais murs médiévaux). L'eau libérée lors de la réaction reforme de l'acide carbonique qui va être fixé par la chaux, etc....
Ca(OH)2 + CO2 + H2O => Ca(OH)2 + H2CO3 => CaCO3 + 2 H2O
La chaux hydraulique, découverte au XIXème siècle, est obtenue avec un calcaire contenant un certain pourcentage d'argile, elle est appelée ainsi, car elle durcit, en quelques heures, en présence d'eau.
A la cuisson, la silice (SiO2) et l'alumine contenues dans l'argile vont se combiner à la chaux pour former des silicates de calcium et des alumines de calcium.
Lors de l'extinction de la chaux et surtout lors de la prise du mortier ces molécules vont donner des hydrates. Contrairement à la chaux hydraulique, la chaux doit être éteinte avec la quantité juste d'eau, pas plus, sous peine de durcir. La prise hydraulique est due à ces silicates, toutefois la chaux hydraulique conserve une part de chaux aérienne. La prise aérienne d'une chaux hydraulique avoisine les 30 %. La chaux et les hydrates vont se carbonater au contact de l'air humide, ce qui est la partie aérienne de la prise, ce qui va redonner le calcaire et la silice originelles.
Si le rapport d'argile est encore plus élevé et la température encore plus haute (1400°C), cela donne du ciment. La grande différence est que la silice contenue dans l'argile est alors vitrifiée lors de la cuisson. En mortier, il ne reconstitue pas du calcaire d'origine, mais un autre matériau, c'est pour cela qu'il est dit non-naturel, contrairement à la chaux.
___________________________________________________________________________________________
© 2005-2009 www.troglos.com
Tous droits réservés.
L'ensemble du site ainsi que son contenu (textes, photographies, images, documents, shémas, etc.) sont soumis aux droits d'auteur.
Toute reproduction, représentation, ou diffusion totale ou partielle sont strictement interdites sans autorisation écrite de l'auteur.
© 2005-2009 www.troglos.com
Tous droits réservés.
L'ensemble du site ainsi que son contenu (textes, photographies, images, documents, shémas, etc.) sont soumis aux droits d'auteur.
Toute reproduction, représentation, ou diffusion totale ou partielle sont strictement interdites sans autorisation écrite de l'auteur.
~ °oO°Oo° ~


Quais de chargements à l'usine à chaux de Lormandière et Chaussairie à Rennes en Bretagne. Nous remarquerons le conditionnement de la chaux dans des sacs
Chargement des wagons des sacs de chaux à la gare de Saint-Astier dans le Périgord.
Le cycle de la chaux
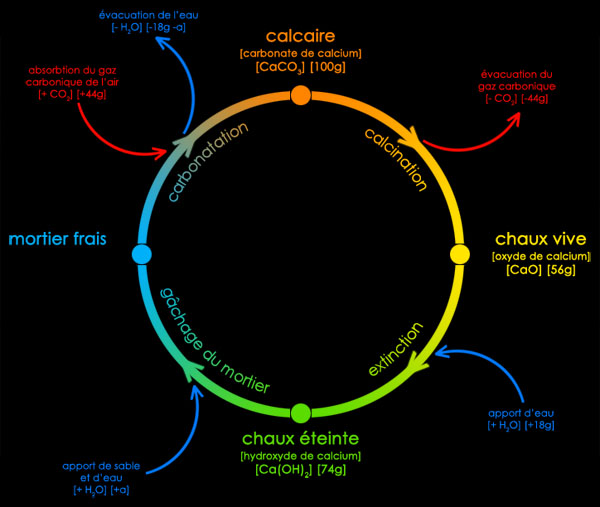
~ °oO°Oo° ~
Principe de l'action de la combustion de la pierre
Le calcaire (carbonate de calcium : CaCO3), en se calcinant, perd son gaz carbonique :
CaCO3 => CaO + CO2
Elle donne alors de l'oxyde de calcium, apellé de manière courante chaux vive. La pierre a alors perdu près de 45 % de son poids.
Elle est appelée ainsi, car elle réagit vivement avec l'eau.
Hydrophile, elle absorbe l'eau qui s'accompagne d'une réaction exothermique (libérant de la chaleur), ainsi,
elle peut être dangereuse et peut causer des démangaisons, voire de sérieuses brûlures.
Ainsi, les chaufourniers la manipulaient avec grande précaution.
Cette chaux vive pouvait être servie pour désinfecter des lieux, comme les étables ou les champignonnières, sous forme de lait de chaux, pour traiter les arbres, pour recouvrir les cadavres des pestiférés, celle-ci absorbant l'eau des matières organiques.
Elle était aussi utilisée pour assécher un lieu (10kg de chaux vive permettent d'absorber 2L d'eau).
Elle est aussi utilisée dans l'amendement des cultures (20 à 40kg pour 1 tonne de terre), afin d'augmenter le pH, de plus, celle-ci détruit aussi les micro-organismes qui pourraient être néfastes pour la culture. Le calcaire (carbonate de calcium) est aussi utilisé non cuit, en poudre, il a le même rôle que la chaux dans le rôle d'augmenter le PH, mais cela est beaucoup plus lent et moins efficace à quantité égale de chaux, par contre, il ne détruit pas les micros-organismes, ni les néfastes, ni ceux bénéfiques ce calcaire est souvent appelé dans ce cas "carbonate de chaux". La poudre de calcaire (chapin) est plus économique que la chaux.
Cette chaux éteinte est conservée dans des récipients hermétiques, à l'abri de l'air afin d'éviter sa carbonatation (absorption de CO2).
Le calcaire (carbonate de calcium : CaCO3), en se calcinant, perd son gaz carbonique :
CaCO3 => CaO + CO2
Elle donne alors de l'oxyde de calcium, apellé de manière courante chaux vive. La pierre a alors perdu près de 45 % de son poids.
Elle est appelée ainsi, car elle réagit vivement avec l'eau.
Hydrophile, elle absorbe l'eau qui s'accompagne d'une réaction exothermique (libérant de la chaleur), ainsi,
elle peut être dangereuse et peut causer des démangaisons, voire de sérieuses brûlures.
Ainsi, les chaufourniers la manipulaient avec grande précaution.
Cette chaux vive pouvait être servie pour désinfecter des lieux, comme les étables ou les champignonnières, sous forme de lait de chaux, pour traiter les arbres, pour recouvrir les cadavres des pestiférés, celle-ci absorbant l'eau des matières organiques.
Elle était aussi utilisée pour assécher un lieu (10kg de chaux vive permettent d'absorber 2L d'eau).
Elle est aussi utilisée dans l'amendement des cultures (20 à 40kg pour 1 tonne de terre), afin d'augmenter le pH, de plus, celle-ci détruit aussi les micro-organismes qui pourraient être néfastes pour la culture. Le calcaire (carbonate de calcium) est aussi utilisé non cuit, en poudre, il a le même rôle que la chaux dans le rôle d'augmenter le PH, mais cela est beaucoup plus lent et moins efficace à quantité égale de chaux, par contre, il ne détruit pas les micros-organismes, ni les néfastes, ni ceux bénéfiques ce calcaire est souvent appelé dans ce cas "carbonate de chaux". La poudre de calcaire (chapin) est plus économique que la chaux.
Cette chaux éteinte est conservée dans des récipients hermétiques, à l'abri de l'air afin d'éviter sa carbonatation (absorption de CO2).